高中化学会考知识点|高中化学常考的100个知识点总结( 二 )
④查:检查书写离子方程式等式两边是否原子个数守恒、电荷数守恒 。
10、常见易溶的强电解质有:
三大强酸(H2SO4、HCl、HNO3),四大强碱[NaOH、KOH、Ba(OH)2、Ca(OH)2 (澄清石灰水拆,石灰乳不拆)],可溶性盐
11、离子方程式正误判断:(看几看)
①看是否符合反应事实(能不能发生反应,反应物、生成物对不对) 。
②看是否可拆 。
③看是否配平(原子个数守恒,电荷数守恒) 。
④看“=”“ ”“↑”“↓”是否应用恰当 。
12、离子共存问题
(1)由于发生复分解反应(生成沉淀或气体或水)的离子不能大量共存 。
生成沉淀:AgCl、BaSO4、BaSO3、BaCO3、CaCO3、Mg(OH)2、Cu(OH)2等 。
生成气体:CO32-、HCO3-等易挥发的弱酸的酸根与H+不能大量共存 。
生成H2O:①H+和OH-生成H2O 。②酸式酸根离子如:HCO3-既不能和H+共存,也不能和OH-共存 。如:HCO3-+H+=H2O+CO2↑,HCO3-+OH-=H2O+CO32-
(2)审题时应注意题中给出的附加条件 。
①无色溶液中不存在有色离子:Cu2+、Fe3+、Fe2+、MnO4-(常见这四种有色离子) 。
②注意挖掘某些隐含离子:酸性溶液(或pH<7)中隐含有H+,碱性溶液(或pH>7)中隐含有OH- 。
③注意题目要求“大量共存”还是“不能大量共存” 。
13、氧化还原反应
(1)氧化还原反应的本质:有电子转移(包括电子的得失或偏移) 。
(2)氧化还原反应的特征:有元素化合价升降 。
(3)判断氧化还原反应的依据:凡是有元素化合价升降或有电子的转移的化学反应都属于氧化还原反应 。
(4)氧化还原反应相关概念:
还原剂(具有还原性):失(失电子)→升(化合价升高)→氧(被氧化或发生氧化反应)→生成氧化产物 。
氧化剂(具有氧化性):得(得电子)→降(化合价降低)→还(被还原或发生还原反应)→生成还原产物 。
【注】一定要熟记以上内容,以便能正确判断出一个氧化还原反应中的氧化剂、还原剂、氧化产物和还原产物;氧化剂、还原剂在反应物中找;氧化产物和还原产物在生成物中找 。
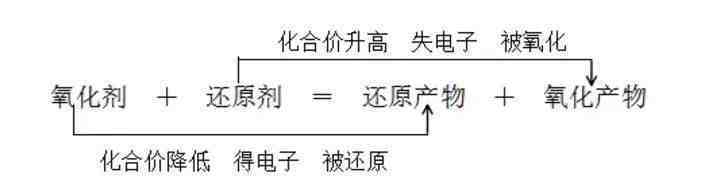
14、氧化性、还原性强弱的判断
(1)根据氧化还原反应方程式在同一氧化还原反应中,
氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物
15、如果使元素化合价升高,即要使它被氧化,要加入氧化剂才能实现;如果使元素化合价降低,即要使它被还原,要加入还原剂才能实现;
16、钠 Na的特质
(1)单质钠的物理性质:钠质软、银白色、熔点低、密度比水的小但比煤油的大 。
(2)钠的存在:以化合态存在 。
(3)钠的保存:保存在煤油或石蜡中 。
(4)钠在空气中的变化过程:Na→Na2O→NaOH→Na2CO3→Na2CO310H2O(结晶)→Na2CO3(风化),最终得到是一种白色粉末 。
一小块钠置露在空气中的现象:银白色的钠很快变暗(生成Na2O),跟着变成白色固体(NaOH),然后在固体表面出现小液滴(NaOH易潮解),最终变成白色粉未(最终产物是Na2CO3) 。
17、钠与O2反应
常温下:4Na + O2=2Na2O (新切开的钠放在空气中容易变暗)
加热时:2Na + O2==Na2O2(钠先熔化后燃烧,发出黄色火焰,生成淡黄色固体Na2O2 。)
Na2O2中氧元素为-1价,Na2O2既有氧化性又有还原性 。
2Na2O2+2H2O=4NaOH+O2↑
2Na2O2+2CO2=2Na2CO3+O2
Na2O2是呼吸面具、潜水艇的供氧剂,Na2O2具有强氧化性能漂白 。
18、钠与H2O反应
2Na+2H2O=2NaOH+H2↑
离子方程式:2Na+2H2O=2Na++2OH-+H2↑(注意配平)
实验现象:“浮——钠密度比水小;游——生成氢气;响——反应剧烈;
熔——钠熔点低;红——生成的NaOH遇酚酞变红” 。
19、钠与盐溶液反应
如钠与CuSO4溶液反应,应该先是钠与H2O反应生成NaOH与H2,再和CuSO4溶液反应,有关化学方程式:
2Na+2H2O=2NaOH+H2↑
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
总的方程式:2Na+2H2O+CuSO4=Cu(OH)2↓+Na2SO4+H2↑
实验现象:有蓝色沉淀生成,有气泡放出
K、Ca、Na三种单质与盐溶液反应时,先与水反应生成相应的碱,碱再和盐溶液反应
20、钠与酸反应:
2Na+2HCl=2NaCl+H2↑(反应剧烈)
离子方程式:2Na+2H+=2Na++H2↑
21、铝 Al的特质
(1)单质铝的物理性质:银白色金属、密度小(属轻金属)、硬度小、熔沸点低 。
(2)单质铝的化学性质
22、铝与O2反应:
- 诺贝尔奖|历年诺贝尔化学奖得主名单 诺贝尔化学奖历年得主和成就
- 《高中生生涯规划与报考指南》的读后感大全
- 高中美术培训总结怎么写?
- 《毛毛》读后感作文怎么写?
- 给同学高中毕业赠言如何写?
- 高中毕业临别赠言写法怎么样?
- 高中素质活动社会实践报告怎么写?
- 高中学生会主席的演讲稿如何写?
- 数学高中家长会发言稿怎么写?
- 左耳读后感作文1000字怎么写?