高中化学会考知识点|高中化学常考的100个知识点总结( 七 )
(3)氨气的实验室制法:
①原理:铵盐与碱共热产生氨气
②装置特点:固+固气体,与制O2相同 。
③收集:向下排空气法 。
④验满:
a. 湿润的红色石蕊试纸(NH3是唯一能使湿润的红色石蕊试纸变蓝的气体)
b. 蘸浓盐酸的玻璃棒(产生白烟)
⑤干燥:用碱石灰(NaOH与CaO的混合物)或生石灰在干燥管或U型管中干燥 。不能用CaCl2、P2O5、浓硫酸作干燥剂,因为NH3能与CaCl2反应生成CaCl28NH3 。P2O5、浓硫酸均能与NH3反应,生成相应的盐 。所以NH3通常用碱石灰干燥 。
⑥吸收:在试管口塞有一团湿的棉花其作用有两个:一是减小氨气与空气的对流,方便收集氨气;二是吸收多余的氨气,防止污染空气 。
(4)氨气的用途:液氨易挥发,汽化过程中会吸收热量,使得周围环境温度降低,因此,液氨可以作制冷剂 。
49、铵盐
铵盐均易溶于水,且都为白色晶体(很多化肥都是铵盐) 。
(1)受热易分解,放出氨气:
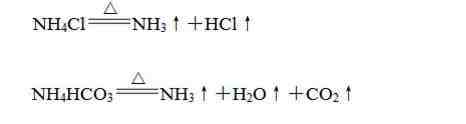
(2)干燥的铵盐能与碱固体混合加热反应生成氨气,利用这个性质可以制备氨气:
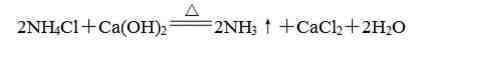
【高中化学会考知识点|高中化学常考的100个知识点总结】
(3)NH4+的检验:样品加碱混合加热,放出的气体能使湿的红色石蕊试纸变蓝,则证明该物质会有NH4+ 。高中化学必修二50、原子核外电子的排布规律:
①电子总是尽先排布在能量最低的电子层里;
②各电子层最多容纳的电子数是2n2;
③最外层电子数不超过8个(K层为最外层不超过2个),次外层不超过18个,倒数第三层电子数不超过32个 。
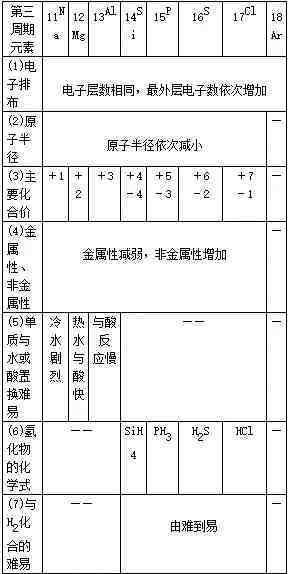
51、同周期元素性质递变规律
第ⅠA族碱金属元素:Li Na KRb Cs Fr(Fr是金属性最强的元素,位于周期表左下方)
第ⅦA族卤族元素:F Cl Br IAt(F是非金属性最强的元素,位于周期表右上方)
52、判断元素金属性和非金属性强弱的方法:
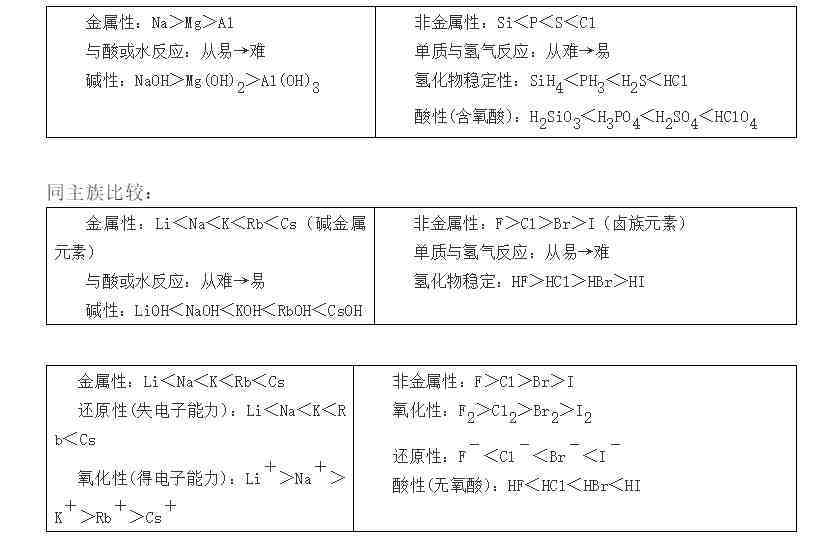
(1)金属性强(弱)——①单质与水或酸反应生成氢气容易(难);②氢氧化物碱性强(弱);③相互置换反应(强制弱)Fe+CuSO4=FeSO4+Cu 。
(2)非金属性强(弱)——①单质与氢气易(难)反应;②生成的氢化物稳定(不稳定);③最高价氧化物的水化物(含氧酸)酸性强(弱);④相互置换反应(强制弱)2NaBr+Cl2=2NaCl+Br2 。
同周期比较:
比较粒子(包括原子、离子)半径的方法:
(1)先比较电子层数,电子层数多的半径大 。
(2)电子层数相同时,再比较核电荷数,核电荷数多的半径反而小 。
53、离子键与共价键的比较
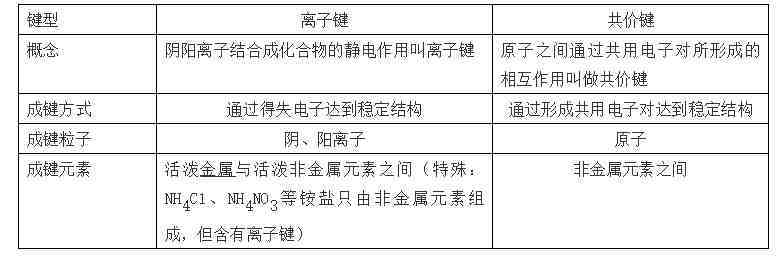
离子化合物:由离子键构成的化合物叫做离子化合物 。(一定有离子键,可能有共价键)
共价化合物:原子间通过共用电子对形成分子的化合物叫做共价化合物 。(只有共价键)

54、电子式:
用电子式表示离子键形成的物质的结构与表示共价键形成的物质的结构的不同点:
(1)电荷:用电子式表示离子键形成的物质的结构需标出阳离子和阴离子的电荷;而表示共价键形成的物质的结构不能标电荷 。
(2)[ ](方括号):离子键形成的物质中的阴离子需用方括号括起来,而共价键形成的物质中不能用方括号 。
55、常见的放热反应
①所有的燃烧与缓慢氧化 。
②酸碱中和反应 。
③金属与酸反应制取氢气 。
④大多数化合反应(特殊:是吸热反应) 。

56、常见的吸热反应:
① 以C、H2、CO为还原剂的氧化还原反应如:
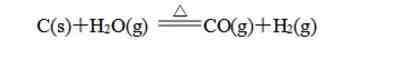
②铵盐和碱的反应如Ba(OH)28H2O+NH4Cl=BaCl2+2NH3↑+10H2O
② 大多数分解反应如KClO3、KMnO4、CaCO3的分解等 。
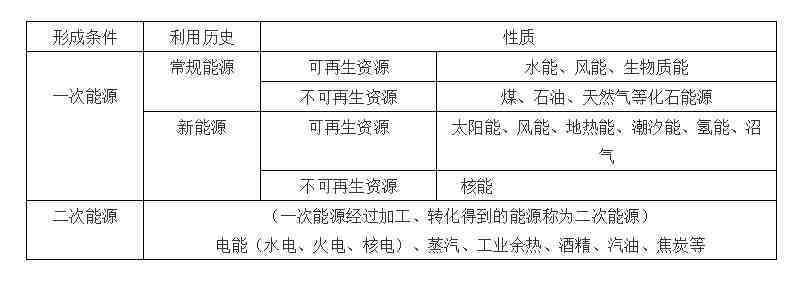
57、能源的分类:
【思考】一般说来,大多数化合反应是放热反应,大多数分解反应是吸热反应,放热反应都不需要加热,吸热反应都需要加热,这种说法对吗?试举例说明 。
点拔:这种说法不对 。如C+O2=CO2的反应是放热反应,但需要加热,只是反应开始后不再需要加热,反应放出的热量可以使反应继续下去 。Ba(OH)28H2O与NH4Cl的反应是吸热反应,但反应并不需要加热 。
- 诺贝尔奖|历年诺贝尔化学奖得主名单 诺贝尔化学奖历年得主和成就
- 《高中生生涯规划与报考指南》的读后感大全
- 高中美术培训总结怎么写?
- 《毛毛》读后感作文怎么写?
- 给同学高中毕业赠言如何写?
- 高中毕业临别赠言写法怎么样?
- 高中素质活动社会实践报告怎么写?
- 高中学生会主席的演讲稿如何写?
- 数学高中家长会发言稿怎么写?
- 左耳读后感作文1000字怎么写?
