氧化铁的化学式|陶釉色中氧化铁的呈色作 用( 二 )
元明初 钧窑玫瑰紫釉尊 「三」字款

讨论与分析
(一)氧化铁在瓷釉中的呈色
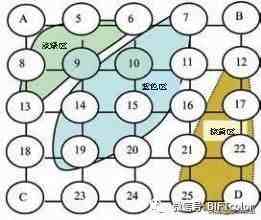
还原条件下烧成,含适量铁的釉色仅为深浅不同的青色但在电炉中性焰条件下其色彩变化很丰富,能够充分显示氧化铁在瓷釉中呈色变化规律 。在上述实验配方中如果不引入氧化铁,或引入氧化铁含量不足时,四角配料中的釉在ABC三角区大多呈乳白色,在方解石含量较高一角,釉呈无色透明状 。当氧化铁含量较高时,可以得到包括蓝、绿、棕黄等多种釉色,如〔图一〕所示 。对应〔图一〕中15号釉呈微乳浊海蓝色,而7、9、10、14的呈色随温度变化较大,并出现了氧化铁的富集与析晶 。低温下7号釉底色偏黄,9、10偏绿,但温度达1230℃,7号呈海蓝,9号绿中泛蓝,有绿色圈纹,10号呈乳蓝色,14号为乳蓝底上有蓝圈纹,15号为蓝紫色〔图二〕 。超过这个温度,多数釉面边缘呈棕色,中心区域的蓝色呈现消退并向棕色变化趋势 。

宋 钧窑天蓝釉紫斑碗
从〔图二〕可以看出,随着烧成温度的升高,富集的氧化铁由红斑边缘向蓝色转变,并由其聚集体的边缘向外扩展成蓝圈纹,后扩散至整个釉层变蓝,在更高温度下斑纹则消失 。而在氧化铁含量 较低的釉中则无此直观现象 。
〔图一〕 釉的组成与釉色关系
〔图二〕釉色随组成与烧成温度的变化
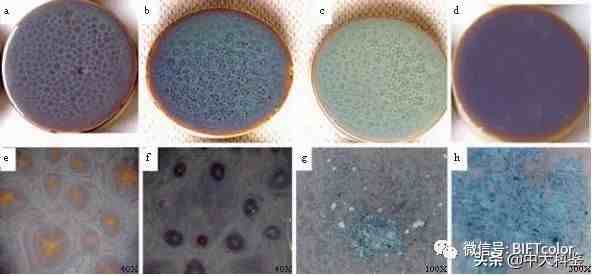
a. 14 # 较低温度 b. 14 # 正烧温度 c. 9#正烧温度 d. 15#正烧温度e. a的高倍图 f. b的高倍图 g. f的高倍图 h. g的高倍图
体的边缘向外扩展成蓝圈纹,后扩散至整个釉层变蓝,在更高温度下斑纹则消失 。而在氧化铁含量较低的釉中则无此直观现象 。
氧化铁在釉中如此丰富的着色,涉及诸多方面的因素 。过渡金属在玻璃中以离子状态存在,其价电子在不同能级间跃迁,由此引起对可见光的选择性吸收,导致着色 。元素铁(Fe)核外电子层排布为[Ar]3d54s2,在电离时可失去最外层的两个4s电子而形成二价铁离子(Fe2+),也可进一步失去一个d电子而形成三价铁离子(Fe3+) 。因此,Fe2+的核外电子排布为[Ar] 3d64s0,而Fe3+的核外电子排布为[Ar]3d54s0 。由于d轨道有5个电子时已是较稳定的半充满状态,进一步电离的电离能将是很高的,所以铁离子常呈正二价和正三价,而不会出现其它价态 。两种离子在可见光区域都没有吸收峰,即不会产生着色 。Fe2+极易氧化,因此自然界极少见到纯的亚铁氧化物 。高温下Fe3+氧化物也不太稳定,易于分解生成Fe2+ 。所以,大多情况下是Fe2+和Fe3+共同存在,且在不同的外场条件下保持不同比例的平衡关系,从而呈现出颜色来 。如普鲁士蓝色料的分子式为Fe4[Fe(CN)6]3,同一分子中含有Fe2+和Fe3+,为其铁氰化物 。铁蓝制备的关键步骤之一,即是制备白浆,而此白浆主成分即为亚铁氰酸的亚铁盐,只有将其酸煮及氧化后,才能得到铁蓝 。新制硅酸亚铁凝胶沉淀物为白色,当其暴露于空气时,变成蓝色,然后经过绿色,黄色阶段最终成棕色 。蓝铁矿(磷酸亚铁)Fe3(PO4)28H2O,原本为白色,一旦在有氧环境中,随着氧化的进行颜色从绿色-钴蓝绿色-不透明的蓝色直至发蓝的黑色变化,这些颜色的变化均显示两种价态铁离子的存在,以及其含量比例的变化引起颜色的变化,当然也与其形成配合物的配位体有关 。

【氧化铁的化学式|陶釉色中氧化铁的呈色作 用】
北宋钧窑天青釉红斑玉壶春瓶在硅酸盐玻璃中,Fe2+和Fe3+也总是共存的,其中,Fe3+能以八面体6配位[FeO6]和四面体4配位[FeO4]两种结构状态存在 。当Fe3+以四面[FeO4]存在时,具有与硅氧四面体[SiO4]相似的结构,这时Fe3+的着色能力较强,且强烈吸收紫外线并延伸至可见光区,使玻璃呈黄绿色 。当Fe3+以八面体[FeO6]存在时,则其位于网络空隙之间,这样结构中的Fe3+在可见光区基本无吸收,玻璃接近无色或带很淡的品红色 。
关于铁在玻璃体中的存在形式,Weyl教授曾进行了系统的研究,认为玻璃中铁的氧化价态存在着以下动态平衡关系:

由此可见,随着釉中铁元素含量的多寡、烧成温度及气氛,其他杂质元素、基础组成酸碱度等的影响,则可能出现蓝、绿、黄、棕及其过渡色等多种颜色效果 。
- 高铁的火灾应急预案范文有没有?
- 地铁的实习报告怎么写?
- 地铁的实习报告
- 钢厂回收废铁价位,钢厂是怎么回收废铁的
- 黄铜矿 - 黄铜矿的化学式CuFeS2怎么读
- 轮毂镀铬大概多少钱,铝合金轮毂氧化修复
- 近期铁的价格是多少钱一斤_废铁能涨到4000元一吨吗
- 关于乘座高铁的诗词
- 阳极氧化一般怎么收费_阳极板多少钱一吨
- 钒的价格走势k线图,五氧化二钒近3年走势图
