高一化学必修二知识点总结|高一化学必修二笔记整理
高一化学必修二知识点总结(高一化学必修二笔记整理)
第一章 物质结构 元素周期律

一、原子结构
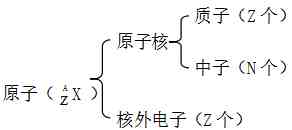
注意:质量数(A)=质子数(Z)+中子数(N)
原子序数=核电荷数=质子数=原子的核外电子数
熟背前20号元素,熟悉1~20号元素原子核外电子的排布:
H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca
2.原子核外电子的排布规律:
①电子总是尽先排布在能量最低的电子层里;
②各电子层最多容纳的电子数是2n2;
③最外层电子数不超过8个(K层为最外层不超过2个),次外层不超过18个,倒数第三层电子数不超过32个 。
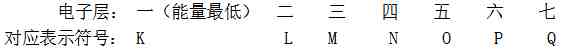
3.元素、核素、同位素
元素:具有相同核电荷数的同一类原子的总称 。
核素:具有一定数目的质子和一定数目的中子的一种原子 。
同位素:质子数相同而中子数不同的同一元素的不同原子互称为同位素 。(对于原子来说)
二、元素周期表
1.编排原则:
①按原子序数递增的顺序从左到右排列
②将电子层数相同的各元素从左到右排成一横行 。(周期序数=原子的电子层数)
③把最外层电子数相同的元素按电子层数递增的顺序从上到下排成一纵行 。
主族序数=原子最外层电子数
2.结构特点:

三、元素周期律
1.元素周期律:元素的性质(核外电子排布、原子半径、主要化合价、金属性、非金属性)随着核电荷数的递增而呈周期性变化的规律 。元素性质的周期性变化实质是元素原子核外电子排布的周期性变化的必然结果 。
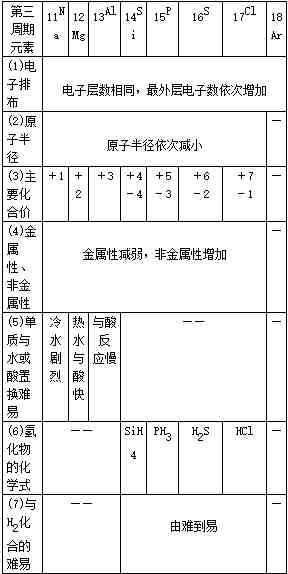
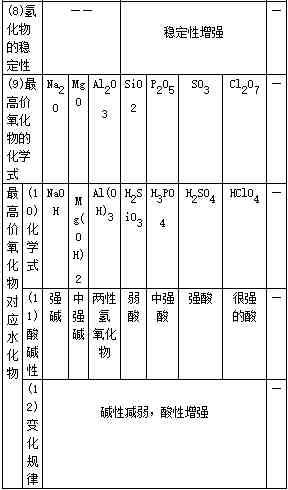
2.同周期元素性质递变规律
第ⅠA族碱金属元素:Li Na K Rb Cs Fr(Fr是金属性最强的元素,位于周期表左下方)
第ⅦA族卤族元素:F Cl Br I At(F是非金属性最强的元素,位于周期表右上方)
判断元素金属性和非金属性强弱的方法:
(1)金属性强(弱)——①单质与水或酸反应生成氢气容易(难);②氢氧化物碱性强(弱);③相互置换反应(强制弱)Fe+CuSO4=FeSO4+Cu 。
(2)非金属性强(弱)——①单质与氢气易(难)反应;②生成的氢化物稳定(不稳定);③最高价氧化物的水化物(含氧酸)酸性强(弱);④相互置换反应(强制弱)2NaBr+Cl2=2NaCl+Br2 。
同周期比较:
金属性:Na>Mg>Al
与酸或水反应:从易→难
碱性:NaOH>Mg(OH)2>Al(OH)3
非金属性:Si<P<S<Cl
单质与氢气反应:从难→易
氢化物稳定性:SiH4<PH3<H2S<HCl
酸性(含氧酸):H2SiO3<H3PO4<H2SO4<HClO4
同主族比较:
金属性:Li<Na<K<Rb<Cs(碱金属元素)
与酸或水反应:从难→易
碱性:LiOH<NaOH<KOH<RbOH<CsOH
非金属性:F>Cl>Br>I(卤族元素)
单质与氢气反应:从易→难
氢化物稳定:HF>HCl>HBr>HI
金属性:Li<Na<K<Rb<Cs
还原性(失电子能力):Li<Na<K<Rb<Cs
氧化性(得电子能力):Li+>Na+>K+>Rb+>Cs+
非金属性:F>Cl>Br>I
氧化性:F2>Cl2>Br2>I2
还原性:F-<Cl-<Br-<I-
酸性(无氧酸):HF<HCl<HBr<HI
比较粒子(包括原子、离子)半径的方法:
(1)先比较电子层数,电子层数多的半径大 。
(2)电子层数相同时,再比较核电荷数,核电荷数多的半径反而小 。
四、化学键
化学键是相邻两个或多个原子间强烈的相互作用 。
1.离子键与共价键的比较
键型
离子键
共价键
概念
阴阳离子结合成化合物的静电作用叫离子键
原子之间通过共用电子对所形成的相互作用叫做共价键
成键方式
通过得失电子达到稳定结构
通过形成共用电子对达到稳定结构
- 诺贝尔奖|历年诺贝尔化学奖得主名单 诺贝尔化学奖历年得主和成就
- 学会自愈,是生命的必修课
- 魔高一尺,道高一丈
- 高一学生上学期期末评语怎么写?
- 高一军训第一天心得感悟范文有没有?
- 高一的周记格式怎么样?
- 新学期高一历史教师工作计划怎么写?
- 新学期高一新生学习计划格式怎么样?
- 高一上学期地理教学计划如何写?
- 高一上学期历史教学计划范文有没有?
