高一化学必修二知识点总结|高一化学必修二笔记整理( 三 )
(5)原电池正负极的判断方法:
①依据原电池两极的材料:
较活泼的金属作负极(K、Ca、Na太活泼,不能作电极);
较不活泼金属或可导电非金属(石墨)、氧化物(MnO2)等作正极 。
②根据电流方向或电子流向:(外电路)的电流由正极流向负极;电子则由负极经外电路流向原电池的正极 。
③根据内电路离子的迁移方向:阳离子流向原电池正极,阴离子流向原电池负极 。
④根据原电池中的反应类型:
负极:失电子,发生氧化反应,现象通常是电极百思特网本身消耗,质量减小 。
正极:得电子,发生还原反应,现象是常伴随金属的析出或H2的放出 。
(6)原电池百思特网电极反应的书写方法:
①原电池反应所依托的化学反应原理是氧化还原反应,负极反应是氧化反应,正极反应是还原反应 。因此书写电极反应的方法归纳如下:
写出总反应方程式;
把总反应根据电子得失情况,分成氧化反应、还原反应;
氧化反应在负极发生,还原反应在正极发生,反应物和生成物对号入座,注意酸碱介质和水等参与反应 。
②原电池的总反应式一般把正极和负极反应式相加而得 。
(7)原电池的应用:
①加快化学反应速率,如粗锌制氢气速率比纯锌制氢气快 。
②比较金属活动性强弱 。
③设计原电池 。
④金属的腐蚀 。
3、化学电源基本类型:
①干电池:活泼金属作负极,被腐蚀或消耗 。如:Cu-Zn原电池、锌锰电池 。
②充电电池:两极都参加反应的原电池,可充电循环使用 。如铅蓄电池、锂电池和银锌电池等 。
③燃料电池:两电极材料均为惰性电极,电极本身不发生反应,而是由引入到两极上的物质发生反应,如H2、CH4燃料电池,其电解质溶液常为碱性试剂(KOH等) 。
第三节 化学反应的速率和限度

1、化学反应的速率
(1)概念:化学反应速率通常用单位时间内反应物浓度的减少量或生成物浓度的增加量(均取正值)来表示 。
计算公式:
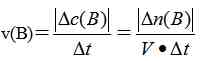
①单位:mol/(Ls)或mol/(Lmin)
②B为溶液或气体,若B为固体或纯液体不计算速率 。
③以上所表示的是平均速率,而不是瞬时速率 。
④重要规律:
速率比=方程式系数比
变化量比=方程式系数比
(2)影响化学反应速率的因素:
内因:由参加反应的物质的结构和性质决定的(主要因素) 。
外因:①温度:升高温度,增大速率
②催化剂:一般加快反应速率(正催化剂)
③浓度:增加C反应物的浓度,增大速率(溶液或气体才有浓度可言)
④压强:增大压强,增大速率(适用于有气体参加的反应)
⑤其它因素:如光(射线)、固体的表面积(颗粒大小)、反应物的状态(溶剂)、原电池等也会改变化学反应速率 。
2、化学反应的限度——化学平衡
(1)在一定条件下,当一个可逆反应进行到正向反应速率与逆向反应速率相等时,反应物和生成物的浓度不再改变,达到表面上静止的一种“平衡状态”,这就是这个反应所能达到的限度,即化学平衡状态 。
化学平衡的移动受到温度、反应物浓度、压强等因素的影响 。催化剂只改变化学反应速率,对化学平衡无影响 。
在相同的条件下同时向正、逆两个反应方向进行的反应叫做可逆反应 。通常把由反应物向生成物进行的反应叫做正反应 。而由生成物向反应物进行的反应叫做逆反应 。
在任何可逆反应中,正方应进行的同时,逆反应也在进行 。可逆反应不能进行到底,即是说可逆反应无论进行到何种程度,任何物质(反应物和生成物)的物质的量都不可能为0 。
(2)化学平衡状态的特征:逆、动、等、定、变 。
①逆:化学平衡研究的对象是可逆反应 。
②动:动态平衡,达到平衡状态时,正逆反应仍在不断进行 。
③等:达到平衡状态时,正方应速率和逆反应速率相等,但不等于0 。即v正=v逆≠0 。
- 诺贝尔奖|历年诺贝尔化学奖得主名单 诺贝尔化学奖历年得主和成就
- 学会自愈,是生命的必修课
- 魔高一尺,道高一丈
- 高一学生上学期期末评语怎么写?
- 高一军训第一天心得感悟范文有没有?
- 高一的周记格式怎么样?
- 新学期高一历史教师工作计划怎么写?
- 新学期高一新生学习计划格式怎么样?
- 高一上学期地理教学计划如何写?
- 高一上学期历史教学计划范文有没有?
