高一化学必修二知识点总结|高一化学必修二笔记整理( 二 )
成键粒子
阴、阳离子
原子
成键元素
活泼金属与活泼非金属元素之间(特殊:NH4Cl、NH4NO3等铵盐只由非金属元素组成,但含有离子键)
非金属元素之间
离子化合物:由离子键构成的化合物叫做离子化合物 。(一定有离子键,可能有共价键)
共价化合物:原子间通过共用电子对形成分子的化合物叫做共价化合物 。(只有共价键)

2.电子式:
用电子式表示离子键形成的物质的结构与表示共价键形成的物质的结构的不同点:
(1)电荷:用电子式表示离子键形成的物质的结构需标出阳离子和阴离子的电荷;而表示共价键形成的物质的结构不能标电荷 。
(2)[ ](方括号):离子键形成的物质中的阴离子需用方括号括起来,而共价键形成的物质中不能用方括号 。
第二章 化学反应与能量

第一节 化学能与热能
1、在任何的化学反应中总伴有能量的变化 。
原因:当物质发生化学反应时,断开反应物中的化学键要吸收能量,而形成生成物中的化学键要放出能量 。化学键的断裂和形成是化学反应中能量变化的主要原因 。
一个确定的化学反应在发生过程中是吸收能量还是放出能量,取决于反应物的总能量与生成物的总能量的相对大小 。E反应物总能量>E生成物总能量,为放热反应 。E反应物总能量<E生成物总能量,为吸热反应 。
2、常见的放热反应和吸热反应
常见的放热反应:
①所有的燃烧与缓慢氧化 。
②酸碱中和反应 。
③金属与酸反应制取氢气 。
④大多数化合反应(特殊:
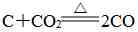
是吸热反应) 。
常见的吸热反应:
①以C、H2、CO为还原剂的氧化还原反应如:
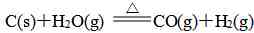
②铵盐和碱的反应如Ba(OH)28H2O+NH4Cl=BaCl2+2NH3↑+10H2O
③大多数分解反应如KClO3、KMnO4、CaCO3的分解等 。
3、能源的分类:
形成条件
利用历史
性质
一次能源
常规能源
可再生资源
水能、风能、生物质能
不可再生资源
煤、石油、天然气等化石能源
新能源
可再生资源
太阳能、风能、地热能、潮汐能、氢能、沼气
不可再生资源
核能
二次能源
(一次能源经过加工、转化得到的能源称为二次能源)
电能(水电、火电、核电)、蒸汽、工业余热、酒精、汽油、焦炭等
【思考】一般说来,大多数化合反应是放热反应,大多数分解反应是吸热反应,放热反应都不需要加热,吸热反应都需要加热,这种说法对吗?试举例说明 。
点拔:这种说法不对 。如C+O2=CO2的反应是放热反应,但需要加热,只是反应开始后不再需要加热,反应放出的热量可以使反应继续下去 。Ba(OH)28H2O与NH4Cl的反应是吸热反应,但反应并不需要加热 。
第二节 化学能与电能
1、化学能转化为电能的方式:
电能
(电力)
火电(火力发电)
化学能→热能→机械能→电能
缺点:环境污染、低效
原电池
将化学能直接转化为电能
优点:清洁、高效
2、原电池原理
(1)概念:把化学能直接转化为电能的装置叫做原电池 。
(2)原电池的工作原理:通过氧化还原反应(有电子的转移)把化学能转变为电能 。
(3)构成原电池的条件:
①电极为导体且活泼性不同;
②两个电极接触(导线连接或直接接触);
③两个相互连接的电极插入电解质溶液构成闭合回路 。
(4)电极名称及发生的反应:
负极:
较活泼的金属作负极,负极发生氧化反应
电极反应式:较活泼金属-ne-=金属阳离子
负极现象:负极溶解,负极质量减少
正极:
较不活泼的金属或石墨作正极,正极发生还原反应
电极反应式:溶液中阳离子+ne-=单质
正极的现象:一般有气体放出或正极质量增加
- 诺贝尔奖|历年诺贝尔化学奖得主名单 诺贝尔化学奖历年得主和成就
- 学会自愈,是生命的必修课
- 魔高一尺,道高一丈
- 高一学生上学期期末评语怎么写?
- 高一军训第一天心得感悟范文有没有?
- 高一的周记格式怎么样?
- 新学期高一历史教师工作计划怎么写?
- 新学期高一新生学习计划格式怎么样?
- 高一上学期地理教学计划如何写?
- 高一上学期历史教学计划范文有没有?
